GPN00833主要活性成分丙酸氯倍他索具有高效的局部抗炎活性和较强的毛细血管收缩作用,产品独特的纳米制剂工艺有效解决了激素产品低水溶性导致的生物利用度低及安全性风险;
研究结果显示,GPN00833在治疗白内障术后抗炎镇痛方面疗效显著优于安慰剂组,且安全性良好;
GPN00833已于2024年3月获得美国FDA批准上市。
近日,远大医药(0512.HK)用于眼科术后抗炎镇痛的激素纳米混悬滴眼液GPN00833完成了在中国开展的III期临床研究并成功达到了临床终点,这是本集团在五官科领域眼科方向的又一次重大里程碑进展。
GPN00833临床疗效显著 已获美国FDA批准上市
关于GPN00833及其临床试验
GPN00833为抗炎镇痛类激素纳米混悬滴眼液,其主要活性成分丙酸氯倍他索是一种强效的糖皮质激素,具有高效的局部抗炎活性和较强的毛细血管收缩作用,同时其独特的纳米制剂工艺有效解决了激素产品低水溶性导致的生物利用度低及安全性风险。
GPN00833于2023年4月在中国获批开展多中心、随机、双盲、安慰剂对照、平行分组III期临床研究,共入组了255例接受白内障手术的患者,以2:1的比例随机分配至研究药物组和安慰剂组,旨在评价GPN00833用于治疗中国人群白内障手术后炎症和疼痛的有效性和安全性。
本研究的主要临床终点为评估白内障手术后至疗程结束的眼部炎症完全消失的受试者比例,次要临床终点为手术后至疗程结束的疼痛完全缓解的受试者比例。其中,消炎的指标为从术后第8天至第15天前房细胞计数为0;止痛的指标为从术后第4天至第15天疼痛评级为0。
研究结果显示,GPN00833可迅速且持久地清除眼部炎症和治愈眼部疼痛,效果在临床及统计学上均显著优于安慰剂。经GPN00833治疗,31.8%的受试者在术后第8天至第15天的前房细胞计数为0,而安慰剂组为20.0%。此外,91.2%的GPN00833组的受试者在术后第4天即达到无眼痛状态并维持至第15天无复发,显著高于安慰剂组的55.3%。此外,该产品的安全性、耐受性良好,且药代动力学特征也符合预期。综上分析显示,GPN00833在治疗白内障术后抗炎镇痛方面疗效显著优于安慰剂组,且安全性良好。
海外注册方面,该产品已于2024年3月获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市。
持续推进创新产品研发 实现业务领域新突破
本集团作为中国主要的五官科药物研发、生产及销售综合企业之一,在售产品管线数量位居行业前列,治疗领域覆盖眼科、耳鼻喉科、口腔科等多科室疾病,覆盖了化学制剂、中药制剂及健康产品,包含处方药、OTC、器械、消费品等几大类别,院内院外全渠道覆盖,打造集“预防+治疗+保健”为一体的“大五官生态圈”。创新研发方面,储备了治疗“近视”、“干眼症”、“翼状胬肉”、“眼科术后抗炎镇痛”、“蠕形螨睑缘炎”和“蠕形螨导致的睑板腺功能障碍”的多款全球创新产品。
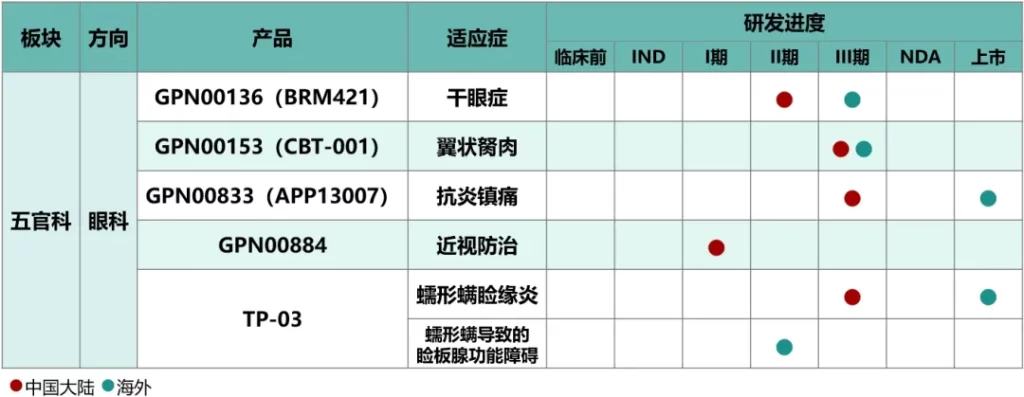
未来,本集团眼科板块将秉持中西联合和药械同治的发展战略,不断强化行业影响力,实现业务领域新突破。
远大医药集团有限公司董事会表示:
“本集团一直高度重视创新产品和先进技术的研发,未来将持续加大对全球创新产品和先进技术的投入,丰富和完善产品管线及产业布局,坚持‘全球化运营布局,双循环经营发展’策略,充分发挥本集团的产业优势和研发实力,快速将科技创新产品落地上市,为全球患者提供更先进更多样的治疗方案。”