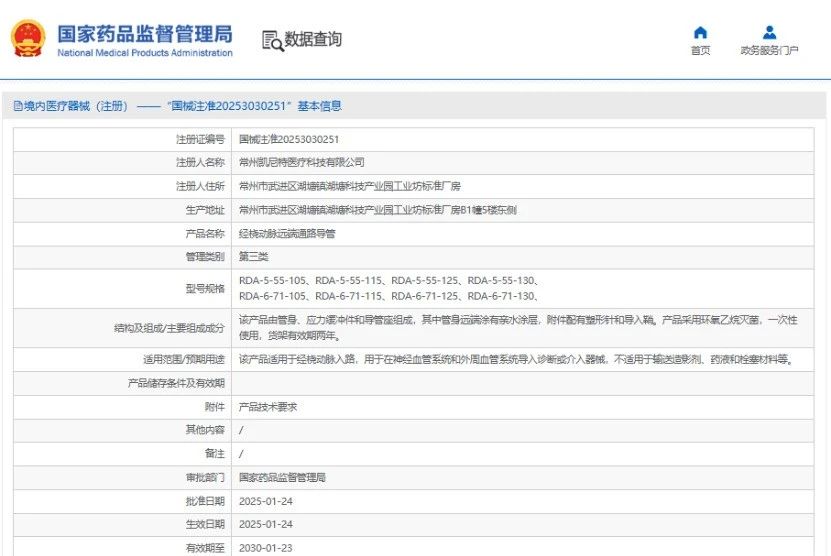
本次临床研究是一项多中心、随机、双盲、安慰剂对照的II期剂量探索性临床研究,旨在评估不同剂量的STC3141在脓毒症患者中的疗效、安全性以及药代动力学特征;
STC3141在治疗脓毒症、ARDS和重症新冠病毒感染的多个临床研究均揭示了该产品在治疗重症领域疾病的良好安全性和临床获益潜力;
STC3141临床前相关研究结果已发表于顶级学术期刊《Nature Communications》和《Critical Care》。
近日,远大医药(0512.HK)全资拥有附属公司Grand Medical Pty Ltd. (一间本集团在澳洲设立的创新药研发中心)开发的全球创新药物STC3141在中国开展的用于治疗脓毒症的II期临床研究完成了全部患者入组并给药,预计将在2025年3月得到初步临床结果。这是本集团在呼吸及重症抗感染领域的又一重大研发进展。
STC3141治疗重症潜力可观 研究结果已发表于顶级学术期刊
关于本次临床研究
本次研究是一项多中心、随机、双盲、安慰剂对照的II期剂量探索性临床研究,入组了180名接受标准治疗和护理的脓毒症患者,采用静脉给药的方式持续给药5天,并随访至第28天,旨在评估不同剂量的STC3141在脓毒症患者中的疗效、安全性以及药代动力学特征。
此前,STC3141在澳洲和比利时开展的用于治疗脓毒症的Ib期临床研究、在中国开展的针对急性呼吸窘迫综合征(ARDS)的Ib期临床研究,以及在欧洲开展的治疗重症新冠病毒感染(COVID-19)的IIa期临床研究均提示了该产品整体的安全性及耐受性良好,且在帮助患者脱离呼吸机、脱离升压药和缩短ICU住院时间等有效性指标方面都体现了积极信号。
STC3141于2023年7月获国家药监局批准开展针对脓毒症的II期临床试验,同年11月完成首例受试者入组,此次比预定计划提前六个月完成II期临床研究的全部受试者入组,是该项目全球开发的又一重要里程碑,将会为后期临床研究和开发方向提供更多数据支持,以加快产品的全球开发进程。
关于STC3141
STC3141是本集团自主开发的全新作用机制的全球创新产品,通过中和胞外组蛋白和中性粒细胞诱捕网来逆转机体过度免疫反应造成的器官损伤,可用于多种重症适应症,如脓毒症和ARDS等临床上死亡率高且缺乏特异性治疗药物的疾病。该产品作用机制创新,临床前相关研究结果于2020年2月及2023年11月分别发表于顶级学术期刊《Nature Communications》和《Critical Care》,具有深远的学术影响力。
临床研究方面,STC3141在中国、澳大利亚、比利时、英国、波兰三大洲五个国家,在脓毒症、ARDS、重症新冠病毒感染以及新冠病毒感染引发的ARDS四个适应症上获批七个临床批件,完成了三项针对患者的临床研究并成功达到了临床终点;于2020年4月和2022年1月分别在澳大利亚和比利时获批开展用于治疗脓毒症的Ib期临床研究,于2023年6月成功达到临床终点;于2021年3月初获得国家药监局批准,在中国开展的针对ARDS患者的Ib期临床研究,于2022年10月完成并成功达到临床终点;于2021年4月、9月和10月分别在比利时、波兰和英国获批治疗重症新冠病毒感染肺炎的IIa期临床研究,于2022年7月完成并成功达到临床终点。
上述多项临床研究均揭示了在治疗重症领域疾病的良好安全性和临床获益潜力,为该产品在重症领域后续的临床开发提供了积极的数据支持。
持续推进创新产品研发 夯实呼吸及危重症管线优势
关于呼吸及危重症板块
呼吸及重症抗感染板块为本集团核心战略板块之一,该板块在售产品覆盖鼻炎、支气管炎、肺炎、哮喘、慢性阻塞性肺部疾患等多个适应症。核心产品切诺(桉柠蒎肠溶胶囊)、恩卓润®比斯海乐®和恩明润®比斯海乐®均为全国独家品种,处于细分领域的领先地位。研发方面,本集团在该板块针对未被满足的重大临床需求进行创新布局,已有多款在研产品覆盖过敏性鼻炎、脓毒症、ARDS等。
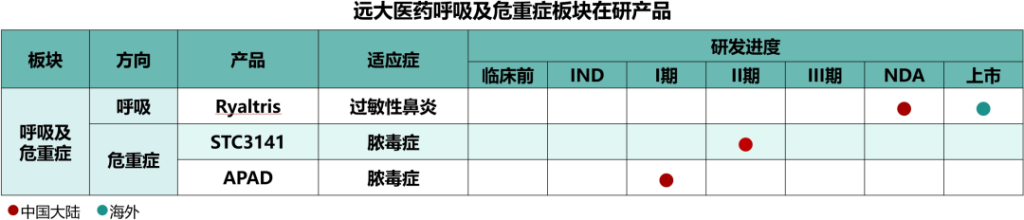
未来,本集团将继续采用自主研发与全球拓展的研发理念,打造气道慢病全周期管理产品集群和重症抗感染产品管线,不断巩固本集团在该领域的行业地位。
远大医药集团有限公司董事会表示:
“本集团一直高度重视创新产品和先进技术的研发,未来将持续加大对全球创新产品和先进技术的投入,丰富和完善产品管线及产业布局,坚持‘全球化运营布局,双循环经营发展’策略,充分发挥本集团的产业优势和研发实力,快速将科技创新产品落地上市,为全球患者提供更先进更多样的治疗方案。”